5月27日,国家食药监总局发布了《药品 、医疗器械 产品注册收费标准》和《药品注册收费实施细则(试行)》、《医疗器械产品注册收费实施细则(试行)》,调整了药品注册收费标准,制定了医疗器械新的收费标准。
药品、医疗器械注册收费是国际通行做法。国家受理生产企业 的药品、医疗器械注册申请和开展审评、审批,需花费大量人力、物力,这部分成本应当由申请者支付,由全体纳税人负担这部分费用是不公平的。
国家食药监总局表示,此前,我国药品注册 收费标准由国家发改委、财政部1995年制定,医疗器械产品注册未收费。由于社会工资水平、物价上涨等原因,收费标准已经严重偏低。以2013年审批国产新药的收费标准为例:澳大利亚98万元(人民币),加拿大176万元,美国1207万元,日本185万元,我国只有3.5万元。
这次收费标准的调整,是按照成本补偿原则确定的。根据国家发改委、财政部规定的测算原则和授权,总局聘请第三方会计师事务所,进行了药品、医疗器械产品注册费成本的测算,确定了新的收费标准。
新标准虽然有了大幅度提高,但与国际上一些国家的收费标准相比依然较低。仍以新药注册收费为例,调整后的国产新药注册申请收费标准为62.4万元,仅相当于澳大利亚的64%、加拿大的35.5%、美国的5.2%,日本的33.7%。
国家收费提高以后,药品注册成本将大大提高,以国家局提到新药申报为例,注册成本是以前的17.83倍,上涨1683%。成本提高后,没事玩玩申报个品种得掂量掂量了。
另外,为了鼓励创新药,符合国务院规定的小微企业提出的符合下列情形的创新药注册申请,免收新药注册费和创新药Ⅱ期或Ⅲ期临床试验补充申请注册费。
Ⅰ.治疗艾滋病、恶性肿瘤,且未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其中药或天然药物制剂。
Ⅱ.未在国内外上市销售的通过合成或者半合成的方法制得的化学原料药及其制剂。
Ⅲ.治疗用生物制品注册分类1.未在国内外上市销售的生物制品。
Ⅳ.预防用生物制品注册分类1.未在国内外上市销售的疫苗。
=============分页符=============
什么是小微企业呢?
根据《关于印发中小企业划型标准规定的通知》(工信部联企业〔2011〕300号)第四条第二款规定:工业,从业人员1000人以下或营业收入40000万元以下的为中小微型企业。其中,从业人员300人及以上,且营业收入2000万元及以上的为中型企业;从业人员20人及以上,且营业收入300万元及以上的为小型企业;从业人员20人以下或营业收入300万元以下的为微型企业。
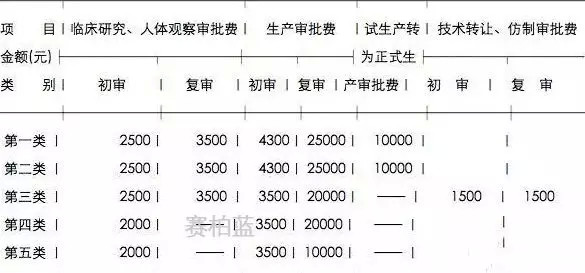
附新旧注册费用对比。
旧注册费用表(单位:元)
新药品注册费标准(单位万元)
|
项目分类
|
国产
|
进口
|
|
|
新药注册费
|
临床试验
|
19.20
|
37.60
|
|
生产/上市
|
43.20
|
59.39
|
|
|
仿制药注册费
|
无需临床试验的生产/上市
|
18.36
|
36.76
|
|
需临床试验的生产/上市
|
31.80
|
50.20
|
|
|
补充申请注册费
|
常规项
|
0.96
|
0.96
|
|
需技术审评的
|
9.96
|
28.36
|
|
|
药品再注册费(五年一次)
|
由省级价格、
财政部门制定
|
22.72
|
|
注:1.药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。
2.《药品注册管理办法》中属于省级食品药品监督管理部门备案或国务院食品药品监督管理部门直接备案的药品补充申请事项,不收取补充申请注册费,如此类申请经审核认为申请内容需要技术审评的,申请人应按照需要技术审评的补充申请的收费标准补交费用。
3.申请一次性进口药品的,收取药品注册费0.20万元。
4.进口药品注册收费标准在国内相应注册收费标准基础上加收国内外检查交通费、住宿费和伙食费等差额。
5.港、澳、台药品注册收费标准按进口药品注册收费标准执行。
医疗器械产品注册费标准(金额:万)